PONEN CÉLULAS INMUNES EN UNA DIETA PARA TRATAR ENFERMEDADES.
Hace alrededor de 12 años, Gary Glick y su esposa notaron algo malo con su hijo, Jeremy. Parecía retrasarse con respecto a su hermana gemela, recuerda el inmunólogo y biólogo químico de la Universidad de Michigan en Ann Arbor. "Crecían al unísono, y de alguna manera se detuvo". Jeremy, que tenía 9 o 10 años en ese momento, también se veía enfermizo y pálido y comenzó a quejarse de dolores persistentes en el estómago y en otros lugares.
Rachel Lipson Glick, un médico, quedó perpleja ante la misteriosa dolencia de su hijo. Lo mismo hicieron otros doctores. Tomó cerca de 3 años para descartar una miríada de cánceres, disfunciones endocrinas y otras posibles causas y para determinar que Jeremy tenía la enfermedad de Crohn, una inflamación del tracto digestivo que se alimentaba al portarse mal con las células inmunes.
El diagnóstico hizo la vida más difícil para Jeremy, ahora de 22 años y un estudiante de último año en la universidad. Para controlar los síntomas, inyecta el fármaco de anticuerpos adalimumab (Humira). Es probable que lo necesite u otro tratamiento de inhibición inmune por el resto de su vida.
Por coincidencia, una de esas alternativas podría derivarse del trabajo de su padre. Gary Glick, como un número cada vez mayor de otros investigadores, está convencido de que las condiciones de conducción de las células inmunes como la enfermedad de Crohn comparten una característica que podría ser su perdición: su metabolismo. Pasó las últimas dos décadas buscando medicamentos que tengan como objetivo las adaptaciones metabólicas de las células inmunes. Los ensayos clínicos de Lycera, una compañía fundada por Glick, están evaluando el primero de esos medicamentos para la psoriasis y la colitis ulcerosa, una enfermedad intestinal relacionada con la enfermedad de Crohn.
Las compañías farmacéuticas están trabajando para desarrollar otros candidatos. Los investigadores también buscan implementar medicamentos existentes que alteren el metabolismo, como los tratamientos para la diabetes como la metformina y la 2-desoxiglucosa (2DG). "Es un momento muy emocionante", dice el inmunólogo Jonathan Powell de la Facultad de Medicina de la Universidad Johns Hopkins en Baltimore, Maryland. "Potencialmente, todas las enfermedades inmunológicas son objetivos para la terapia metabólica".
Los investigadores del cáncer también han intentado alterar el metabolismo celular, incluso probando algunas de las mismas drogas que los inmunólogos están investigando. Pero muchos científicos están convencidos de que la estrategia funcionará mejor para las enfermedades inmunes que para los tumores porque los medicamentos para tratar esas enfermedades solo necesitan suprimir un número relativamente pequeño de células sobreexuberantes, no eliminarlas. Y mientras que las drogas existentes que restringen las células inmunes, como adalimumab, pueden comprometer nuestras defensas contra los patógenos, Glick y otros científicos piensan que ese inconveniente no afectará su estrategia. Centrarse en el metabolismo de las células inmunes hiperactivas, dice, ofrece "una forma de atacar directamente estas células sin afectar la función inmune".

Gary Glick (izquierda) descubrió un medicamento que podría conducir a un tratamiento para la enfermedad autoinmune que afecta a su hijo Jeremy (derecha). © JOE MCNALLY
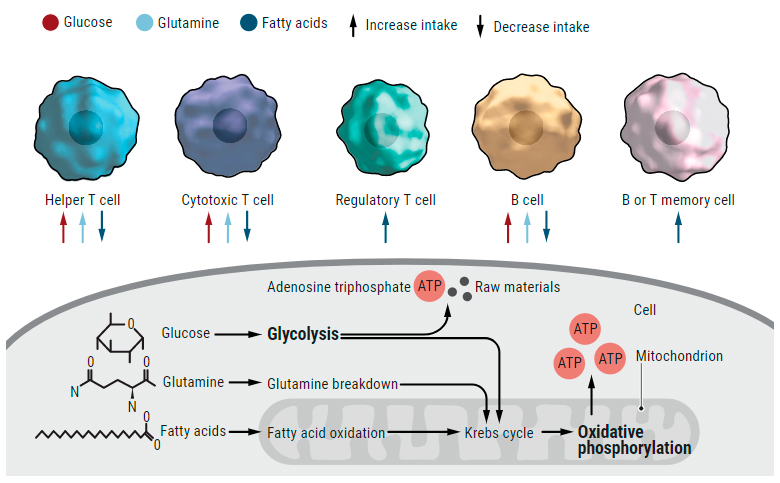
En la década de 1920, el médico y químico alemán Otto Warburg fue el primero en darse cuenta de que las células inmunitarias tienen una forma distintiva de alimentarse. Para potenciar sus actividades, las células necesitan producir la molécula de trifosfato de adenosina (ATP). Pueden hacerlo directamente a través de la glucólisis, una vía bioquímica que desmembra la glucosa. O pueden generar ATP a través de un proceso más complicado llamado fosforilación oxidativa, que requiere moléculas cargadas de energía producidas por la glucólisis, pero también incluye otras reacciones bioquímicas que descomponen los ácidos grasos y aminoácidos como la glutamina.
Las células normales del cuerpo generalmente dependen de la fosforilación oxidativa para la mayoría de sus necesidades de energía, pero Warburg descubrió que las células cancerosas aceleraron la glucólisis. También notó que algunas células sanas dependían de la glucólisis: células inmunes.
Warburg estaba en el camino correcto, pero los investigadores ahora saben que cuando las células inmunes no combaten los patógenos, establecen su metabolismo a niveles bajos y producen ATP principalmente a través de la fosforilación oxidativa. La llegada de una amenaza, como un virus de la gripe que se reproduce en los pulmones, activa las células, galvanizándolas para combatir al invasor. En ese momento, "se someten a estos cambios metabólicos masivos", dice la inmunóloga Erika Pearce del Instituto Max Planck de Inmunobiología y Epigenética en Freiburg, Alemania. Las células estimuladas no solo requieren más energía, señala. Una célula T activada puede dividirse varias veces al día, generando rápidamente un ejército de millones de descendientes. Para sostener esa movilización, las células también requieren grandes cantidades de materias primas, como los precursores de ADN, proteínas y lípidos.
La forma exacta en que una célula inmunitaria activada satisface su demanda masiva de energía y material molecular depende del tipo de célula que es. Las células T auxiliares activadas, que sirven como comandantes inmunes, parecen seguir el paradigma de Warburg. Engullan la glucosa y aumentan la glucólisis, aunque también aumentan la tasa de fosforilación oxidativa en una cantidad menor y consumen más glutamina. Las células T citotóxicas, que matan las células tumorales y las células controladas por virus, adoptan un enfoque similar. Por el contrario, las células T reguladoras inmunosupresoras continúan obteniendo la mayor parte de su energía de la fosforilación oxidativa, incluso después de que entran en acción, y prefieren los ácidos grasos a los aminoácidos y la glucosa.
Las células inmunes también toman diferentes decisiones metabólicas dependiendo de si son células de memoria, que persisten durante años y nos protegen de enfermedades del mismo agente patógeno más de una vez, o células efectoras de vida más corta, especializadas para atacar a los microbios de inmediato. Las células T de memoria, por ejemplo, típicamente favorecen la fosforilación oxidativa y consumen ácidos grasos. Las células efectoras T, por el contrario, aumentan la glucólisis y son pesadas usuarias de glucosa, una diferencia que se refleja en sus mitocondrias, los orgánulos que sirven como plantas de energía celular, Pearce y sus colegas informaron hace 2 años.
Fuentes de energía alternativas
Las células inmunitarias activadas cambian lo que consumen y la ruta metabólica que utilizan para descomponer ese combustible para producir ATP que lleva energía. Algunos tipos aumentan la glucosa, aumentan la glucólisis y consumen más glutamina. Los ácidos grasos siguen siendo un alimento básico para otras células, que aún dependen de la fosforilación oxidativa.
Clic para ampliar la imagen.
N. DESAI / CIENCIA
Aunque las células T de memoria "tienen estas hermosas, intactas, mitocondrias filiformes", dice ella, las células T efectoras pican sus mitocondrias. Los organelos son donde ocurre la fosforilación oxidativa, y romperlos puede hacer que la vía metabólica sea menos eficiente y promover la glucólisis, sugieren los investigadores.
Las adaptaciones metabólicas permiten que las células inmunes desempeñen su función de protección, pero a veces provocan el mal funcionamiento de las células. En la artritis reumatoide, por ejemplo, las células T activadas se deslizan en las articulaciones, dice el inmunólogo Cornelia Weyand de la Universidad de Stanford en Palo Alto, California. "Les gusta allí y se quedan y causan inflamación crónica del tejido".
Ese comportamiento refleja un cambio en el metabolismo. Al igual que otras células T activadas, las células T implicadas en la artritis reumatoide se basan en la glucólisis. Pero modifican ese camino para producir menos ATP y más precursores moleculares necesarios para respaldar su rápida división. Como resultado, las células T se quedan cortas de especies de oxígeno reactivo -máquinas de señalización clave que controlan su comportamiento- y se vuelven deshonestas. Aceleran su reproducción y se especializan en variedades que promueven la inflamación.
Las células también se convierten en mejores gimnastas, hábiles para deslizarse a través de espacios estrechos en las articulaciones. Weyand y sus colegas encontraron que las células T anormales brotaron colmenas en sus membranas celulares que les permitieron penetrar más profundamente en los tejidos. Dentro de la articulación, las células T móviles ayudan a estimular otras células para formar una lesión que se asemeja a una herida que no cicatriza, dice Weyand, y eso causa dolor y un mayor deterioro de las articulaciones. "El metabolismo de la célula controla su comportamiento y su comportamiento no es bueno para el paciente", dice ella.
Pearce dice que la perspectiva de interferir con el metabolismo de las células inmunes para tratar enfermedades asusta a algunos de sus colegas, que temen que paralizar todo el sistema de defensa del cuerpo o dañar otras células vitales. "Si le das un inhibidor de la glucólisis, ¿no va a matar a alguien?" ellos le preguntan. Pero el inmunólogo Jeff Rathmell del Centro Médico de la Universidad de Vanderbilt en Nashville dice que solo una pequeña fracción de las células inmunes y de las células del cuerpo en general aumentan su uso de esas vías y se verían afectadas por las drogas que alteran el metabolismo. "A la mayoría de las células no les importa".
El trabajo en animales sugiere que enfocarse en el metabolismo inmune es un enfoque prometedor. En un estudio de 2015, el inmunólogo Laurence Morel de la Universidad de Florida en Gainesville y sus colegas dosificaron ratones genéticamente modificados para desarrollar una afección lúpica con metformina y 2DG. La metformina reduce la fosforilación oxidativa, mientras que la 2DG silencia la glucólisis. Juntos, las moléculas revirtieron los síntomas del lupus en los animales. Los pacientes con lupus, por ejemplo, bombean anticuerpos que atacan su propio ADN. Pero en los ratones, los niveles de esos anticuerpos disminuyeron en aproximadamente un 50% después de que comenzó el tratamiento. Los investigadores no detectaron signos de que los roedores se volvieran más vulnerables a las infecciones.
En otro estudio, Rathmell y sus colegas agregaron dicloroacetato, que suprime la glucólisis, al agua potable de ratones que tienen una afección que imita a la esclerosis múltiple, en la que el sistema inmunitario ataca la vaina de mielina aislante de los nervios. El compuesto impidió la destrucción de la mielina en los animales y redujo los síntomas neurológicos, como la debilidad muscular, informaron los científicos en 2014.
Impedir el metabolismo celular también podría frenar los ataques del sistema inmune contra los órganos trasplantados, según descubrieron Powell y sus colegas. Le dieron metformina, 2DG y un tercer fármaco que bloquea el metabolismo de la glutamina en ratones que recibieron injertos de piel o trasplantes de corazón. Los injertos de piel sobrevivieron aproximadamente cuatro veces más en los ratones tratados que en los animales de control, que rechazaron rápidamente el tejido. Los corazones trasplantados también funcionaron mucho más tiempo en ratones que recibieron el trío de drogas, informó el equipo en 2015 en Cell Reports.
Los pocos ensayos clínicos que prueban el concepto en personas han utilizado principalmente compuestos ya aprobados como la metformina. Hace dos años, los investigadores argentinos informaron menos nuevas lesiones cerebrales en 30 pacientes con esclerosis múltiple que tomaron metformina u otro fármaco que provoca un cortocircuito en la fosforilación oxidativa. Un ensayo clínico de investigadores chinos está probando si la metformina puede calmar las erupciones de lupus. Y hasta ahora, esas drogas parecen seguras. "La metformina en sí misma hace muy poco para deteriorar la inmunidad, por ejemplo, pero puede reducir la inflamación crónica", dice Rathmell.
Los escépticos señalan que los investigadores también han intentado reutilizar metformina y 2DG para bloquear el metabolismo en las células cancerosas, con resultados inconsistentes. Sin embargo, Powell y otros científicos dicen que no están desanimados. A diferencia de las células cancerosas, "en realidad no tienes que matar una célula [inmune] para modificar su metabolismo", dice Rathmell.
Estos medicamentos no han sido diseñados para modificar el metabolismo de las células inmunes, agrega el biólogo del cáncer Ralph DeBerardinis, del Centro Médico Southwestern de la Universidad de Texas en Dallas. "No debería sorprendernos si no tienen la potencia o la especificidad para tener un efecto significativo".
Algunos científicos piensan que hablar de tratamientos es prematuro. Inhibir las reacciones de producción de energía de las células inmunes en una enfermedad crónica "es una idea atractiva", dice el biólogo mitocondrial Navdeep Chandel de la Escuela de Medicina Feinberg de la Universidad de Northwestern en Chicago, Illinois. Pero él sostiene que los investigadores no entienden el metabolismo de las células inmunes lo suficientemente bien como para saber cómo intervenir de manera segura y efectiva.
Sin embargo, un estudio publicado en línea esta semana en Science proporciona más apoyo que la inhibición del metabolismo inmune puede calmar las enfermedades humanas . El trabajo se centra en un medicamento, el dimetilfumarato, que ya recibió la aprobación de la Administración de Alimentos y Medicamentos de los EE. UU. Como tratamiento para la esclerosis múltiple. Aunque los investigadores sabían que la droga suprime las células inmunes, no estaban seguros de cómo. Un equipo dirigido por científicos de Johns Hopkins informa que el compuesto paraliza una enzima necesaria para la glucólisis, lo que refuerza la idea de que la ruta puede ser atacada por las drogas.
Glick confía en que él y otros están trabajando en algo. El compuesto que descubrió data de la investigación que comenzó a mediados de la década de 1990. "De alguna manera me volví atrás", dice. Glick y sus colegas estaban buscando compuestos que mataran las células B, las células productoras de anticuerpos que ayudan a causar los síntomas del lupus. Después de probar varios compuestos, encontraron uno que bloquea una enzima necesaria para la fosforilación oxidativa.
Lycera está evaluando una versión mejorada de esa molécula en personas con psoriasis o colitis ulcerosa, en parte porque es más fácil probar medicamentos en esas enfermedades que en el lupus, cuyos síntomas afectan a más órganos y son más difíciles de rastrear. A diferencia del adalimumab que inyecta Jeremy Glick, este medicamento se puede tomar en forma de píldora. Lycera planea anunciar los resultados de sus dos ensayos más adelante este año.
Este mes, una nueva compañía fundada por Gary Glick comenzó los ensayos clínicos de un medicamento antiparasitario existente, la niclosamida, en pacientes con colitis ulcerosa. La niclosamida, que mata las tenias inhibiendo la fosforilación oxidativa, tiene un largo historial de seguridad, señala Glick. "Está aprobado para niños y mujeres embarazadas", dice.
Glick estaba buscando compuestos que reprodujeran el metabolismo de las células inmunes años antes de que su hijo fuera diagnosticado con la enfermedad de Crohn, pero dice que la enfermedad de Jeremy le proporcionó una motivación extra. "Si pudiera despertarse todas las mañanas y tomar una pastilla que su padre inventó, estaría encantado", dice Glick.
Fuente:
SCIENCEMAG